用于真正并行多目標成像的光譜分辨熒光壽命成像 (sFLIM)
? 結合壽命和光譜信息,明確識別多種不同的熒光標記
? 可將多種熒光標記與自發熒光進行有效的區分
? 支持高計數率工作,每秒可采集多張sFLIM圖像
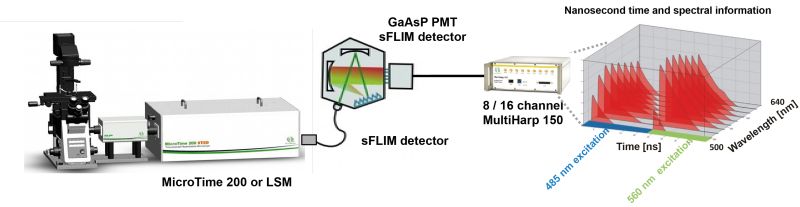

Spectral FLIM (sFLIM) 是一種結合光譜分辨和熒光壽命信息的成像方法。由于各種技術的提升,使sFLIM成為了一種快速、通用且靈敏的檢測手段。其中一項重大的技術改進是使用 16 通道光譜熒光壽命成像探測器。該探測陣列中包含16個配備了GaAsP陰極的PMT檢測器,其探測效率高達45%。sFLIM的探測器陣列連接到具有16個獨立輸入通道的TCSPC模塊——MultiHarp 150。這些輸入通道中的每一路都具有超低的死區時間——650ps,允許在TCSPC直方圖失真最小和幾乎沒有光子計數損失的情況下,進行高計數率的sFLIM測量。
這種組合下的計數率高達65Mcps。由于熒光信號同時被記錄在多個通道中,因此有效地降低了由探測器脈沖堆積效應導致的熒光衰減失真現象。因為MultiHarp 1502超短的死區時間,不會丟棄任何光子,將光子損失控制在最低限度。
另外,也已開發出一種模式匹配方法,通過充分利用光譜和壽命信息,以快速可靠的方式分析sFLIM的測量結果。通過使用多個散點圖,可以一目了然地顯示不同的光譜和壽命種群。通過在散點圖中定義區域,可以推斷出參考模式,然后將其用于sFLIM圖像1的線性分解。這種模式匹配方法可作為公開訪問的MatLab分析例程使用(托管在GitHub上)。請注意,該軟件不是PicoQuant 的常規產品,因此PicoQuant不會為其提供任何技術支持。
sFLIM最具應用前景的方向就是同時測量多個熒光標記,如熒光蛋白,FRET探針或環境敏感探針。也可以區分由于樣品自發熒光引起的熒光背景3。
用于真正并行多目標成像的光譜分辨熒光壽命成像 (sFLIM)
? 結合壽命和光譜信息,明確識別多種不同的熒光標記
? 可將多種熒光標記與自發熒光進行有效的區分
? 支持高計數率工作,每秒可采集多張sFLIM圖像

間接標記技術對一抗和二抗對進行嚴格選擇,以避免假陽性免疫標記。因此,間接免疫熒光通常局限于2~4種抗原,或者在最壞的情況下,目標分子標記的特定結合根本無法進行。
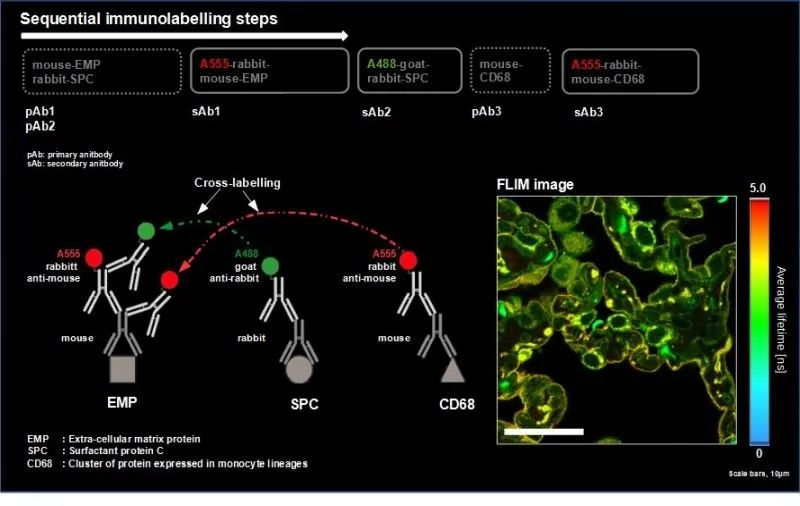
在此應用示例中,我們提出了一種新方法,通過光譜 FLIM-FRET 分離熒光信號來利用二抗交叉標記的表面缺點。這之所以成為可能,是因為二抗之間不希望的交叉標記導致產生新的特征 FRET 發射光譜,包括供體壽命的變化。為了證明這一點,我們采用了一種順序標記方案,并在相互作用的二抗體(如Alexa488和Alexa546)上選擇了合適的熒光團對,以實現強FRET現象。
作為模型,我們在人肺組織中標記了目標分子泛細胞角蛋白、TOM20 和高爾基體蛋白。一抗和二抗的結合導致了TOM20 的單標記以及泛細胞角蛋白的交叉標記。我們使用了一個八通道光譜分辨熒光壽命成像(sFLIM) 的檢測系統,用兩個激光波長在脈沖交替激發 (PIE)模式下,激發所有的標記,并獲取了其數據。
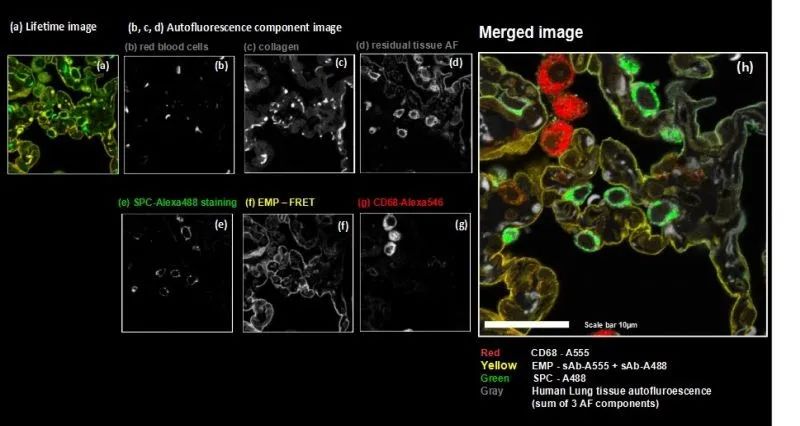
通過采用源自未染色樣品的三種模式來考慮來自人肺組織的強自發熒光(源自紅細胞、膠原蛋白和殘留的自發熒光 (AF))。考慮到發射光譜以及納秒時間分辨熒光衰減3,使用模式匹配算法1進行數據分析。
通過該方法,僅由兩種熒光團產生的熒光,就使我們能夠精確區分所有三種目標分子,這要歸功于熒光團物質的交聯和產生的FRET相互作用。同時,可以分離由人肺組織的三種自發熒光產生的外源熒光。因此,光譜FLIM-FRET與模式匹配分析一起通過克服二抗交叉標記的不良影響和區分不需要的組織自發熒光,形成了用于間接免疫熒光的出色工具。
1 Nieh?rster, T. et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy, Nature Methods, 257-262, 13(3), 2016
2 Wahl, M. et al. Photon arrival time tagging with many channels, sub-nanosecond deadtime, very high throughput, and fiber optic remote synchronization, Review of Scientific Instruments, Vol.091, 013108. 2020
3 Rohilla. S. et al. Multi-target immunofuorescence by separation of antibody crosslabelling via spectral-FLIM-FRET, Scientific Reports, Vol.010, 3820, 2020
4 Meyer, J. et al. Rapid Fluorescence Lifetime Imaging Reveals That TRPV4 Channels Promote Dysregulation of Neuronal Na+ in Ischemia, Journal of Neuroscience, Vol. 42, Issue 4, 2022